Các biểu hiện thường thấy của bệnh bao gồm nhìn đôi, sụp mi, yếu cơ mặt và cổ họng, và suy nhược toàn thân [1]. Những người bị bệnh nhược cơ mất khả năng kiểm soát cơ bắp một cách tự nhiên. Họ bị yếu cơ và mệt mỏi ở nhiều mức độ nghiêm trọng khác nhau. Bệnh nhược cơ là một bệnh thần kinh cơ suốt đời. Không có cách chữa trị tận gốc, nhưng các phương pháp điều trị có thể giúp ích và một số bệnh nhân có thể thuyên giảm.
TẢI FILE PDF TẠI ĐÂY: Điều trị bệnh nhược cơ bằng tế bào gốc
Nguyên nhân và hiện trạng điều trị Bệnh nhược cơ
Bệnh nhược cơ là bệnh tương đối ít gặp, tần suất mắc khoảng 14 trường hợp trên 100.000, chúng có thể xảy ra ở mọi lứa tuổi. Bệnh nhược cơ tự miễn ở trẻ vị thành niên chiếm khoảng 10% đến 15% các trường hợp được chẩn đoán ở Bắc Mỹ. Nguyên nhân của bệnh là không rõ ràng. Các nhà nghiên cứu nghi ngờ virus hoặc vi khuẩn có thể kích hoạt phản ứng tự miễn dịch; tuyến ức đôi khi cũng đóng một vai trò trong bệnh. Khoảng 10% đến 15% những người bị nhược cơ có u tuyến ức tiềm ẩn. Bệnh tuyến giáp tự miễn cũng có thể được coi là nguyên nhân dẫn tới bệnh nhược cơ, người ta thấy có khoảng 3% đến 8% bệnh nhân bị tuyến giáp có kèm bệnh nhược cơ. Sàng lọc các bất thường về tuyến giáp nên là một phần của đánh giá ban đầu. Mặc dù bệnh nhược cơ không di truyền, nhưng yếu tố di truyền dường như đóng một vai trò trong bệnh này và các bệnh tự miễn dịch khác.
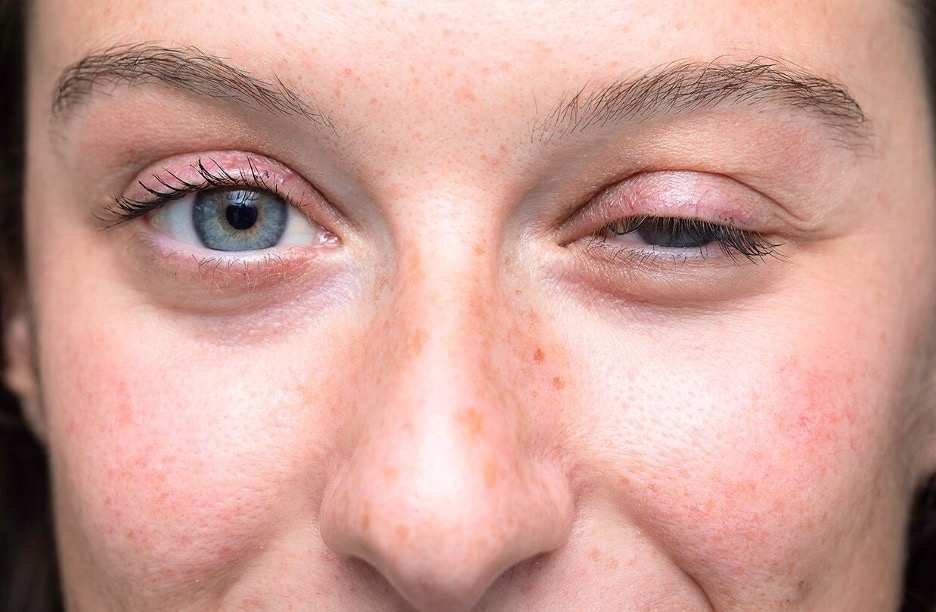
Các triệu chứng phổ biến nhất của bệnh nhược cơ là
- Sụp mi
- Song thị
- Yếu cơ sau khi sử dụng cơ bị ảnh hưởng.
Yếu cơ hồi phục khi các cơ bị ảnh hưởng được nghỉ ngơi nhưng sẽ tái phát khi chúng được vận động trở lại. Liệt do nhược cơ làm giảm nhiệt độ.
Các cơ mắt bị ảnh hưởng đầu tiên ở 40% bệnh nhân và sau đó là 85%, chúng là những cơ duy nhất bị ảnh hưởng ở 15% bệnh nhân. Nếu nhược cơ toàn thân sẽ phát triển sau các triệu chứng ở mắt, nó thường phát triển ở 78% bệnh nhân trong vòng 1 năm và trong 94% trong 3 năm đầu.
Lực bóp tay có thể luôn phiên giữa yếu và bình thường (kiểu vắt sữa). Cơ cổ có thể yếu. Yếu gốc chi là tình trạng phổ biến. Một số bệnh nhân có biểu hiện triệu chứng hành tủy (ví dụ như thay đổi giọng nói, nghẹt mũi, nghẹt thở, khó nuốt). Cảm giác và phản xạ gân sâu còn bình thường. Các biểu hiện dao động về cường độ trong vài phút đến hàng giờ.
- Cơn nhược cơ kịch phátlà tình trạng yếu cơ tứ chi nghiêm trọng hoặc yếu cơ hô hấp đe dọa tính mạng, xảy ra khoảng 15 đến 20% bệnh nhân, ít nhất một lần trong đời. Nó thường xảy ra sau một nhiễm trùng tình cờ, gây tái hoạt hóa hệ miễn dịch. Một khi suy hô hấp bắt đầu xuất hiện, suy hô hấp có thể tiến triển nhanh chóng.
- Cơn cholinergiclà tình trạng yếu cơ có thể xảy ra khi quá liều thuốc kháng cholinesterase (ví dụ, neostigmine, pyridostygmine). Cơn mức độ có thể không biểu hiện rầm rộ, khó phân biệt với tình trạng nhược cơ tiến triển. Cơn cholinergic kịch phát nghiêm trọng thường phân biệt được vì, không giống như nhược cơ, nó gây rung cơ cục bộ, tăng tiết nước mắt và nước bọt, nhịp tim nhanh và tiêu chảy.
Các biện pháp phổ biến để điều trị bệnh nhược cơ hiện nay bao gồm dùng thuốc đường uống, dùng thuốc đường tiêm truyền tĩnh mạch và can thiệp phẫu thuật. Tuy nhiên, việc sử dụng các thuốc đường uống hay thuốc đường tiêm đối với bệnh nhược cơ trong một thời gian dài đều có thể dẫn đến nhiều tác dụng phụ nghiêm trọng, ví dụ như loãng xương, tăng cân, tiểu đường hoặc nhiễm trùng. Bên cạnh đó, việc điều trị bằng đường tiêm truyền tĩnh mạch chỉ được sử dụng trong một vài trường hợp nhất định như bệnh nhược cơ cấp tính. Biện pháp can thiệp phẫu thuật thường được chỉ định khi người bệnh có một khối u trong tuyến ức. Trong trường hợp tệ hơn, dù đã sử dụng những biện pháp điều trị đó, bệnh nhược cơ vẫn có khả năng tái phát và khó ổn định. Do đó, các phương pháp điều trị hiệu quả hơn và ít độc hại hơn phải được phát triển [2, 3].
Tiềm năng điều trị bệnh nhược cơ của tế bào gốc trung mô và môi trường điều hoà từ tế bào gốc trung mô
Tế bào gốc trung mô (MSC) là tế bào gốc trưởng thành đa năng. Chúng đã được phân lập từ nhiều nguồn khác nhau, chẳng hạn như dây rốn, nhau thai, tủy xương, răng và mô mỡ [4, 5]. MSC đã được thử nghiệm trên người và chuột để đánh giá tiềm năng sử dụng trong điều trị bệnh nhược cơ [6]. Giai đoạn cấp tính của bệnh nhân mắc bệnh nhược cơ liên quan đến sự kích hoạt quá mức của hệ thống miễn dịch, trong đó sự tăng sinh của tế bào T đặc hiệu, thụ thể acetylcholine (AchR), đóng vai trò quan trọng cho sự phát triển của bệnh.
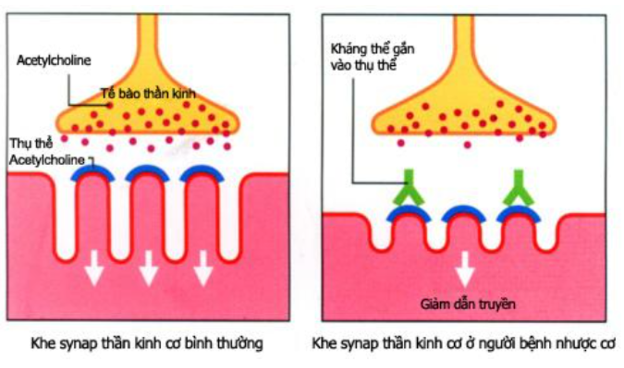
Cơ chế hình thành bệnh nhược cơ
Trong một nghiên cứu trên chuột đánh giá tiềm năng điều trị của MSC, người ta quan sát thấy rằng mức độ kháng thể AchR đã giảm đáng kể ở nhóm được điều trị bằng tế bào khi so sánh với nhóm đối chứng không được điều trị sau 10 ngày kể từ lần tiêm thứ hai. Hơn nữa, cả thử nghiệm in vivo và in vitro cho thấy rằng MSC chắc chắn có thể ức chế sự tăng sinh của tế bào lympho đặc hiệu AchR [7]. Bên cạnh đó, một nghiên cứu khác cũng chỉ ra rằng các yếu tố tăng trưởng tế bào gan (HGF), yếu tố chuyển đổi tăng trưởng beta (TGF-β), indoleamine 2,3-dioxygenase (IDO) và interleukin-10 (IL-10) có tham gia vào quá trình ức chế [8]. Thật thú vị, kết quả đã chứng minh rằng các MSC cải thiện rõ rệt bệnh nhược cơ, giảm mức độ anti-AChR Abs trong huyết thanh và khôi phục biểu hiện AChR ở cơ. Đồng thời, cơ chế điều trị của MSC lên bệnh nhược cơ liên quan đến (1) ức chế tăng sinh tế bào, (2) ức chế các phân tử kích thích và liên quan đến tế bào B, và (3) kích hoạt chất điều hòa bổ thể DAF/CD55.
Tóm lại, các nghiên cứu cho thấy rằng bước điều kiện tiên quyết thúc đẩy tác dụng điều trị của MSC thông qua các cơ chế kết hợp tác dụng chống viêm và ức chế miễn dịch chủ yếu ở tuyến ức, khiến MSC trở thành một chiến lược đầy hứa hẹn để điều trị bệnh nhược cơ và các bệnh tự miễn khác. Môi trường điều hoà của MSC (MSC-CM) trong nuôi cấy in vitro có chứa chủ yếu là các thành phần hệ tiết, gồm có là các protein hoà tan như cytokine hay chemokine được tiết từ MSC, và thể tiết ngoại bào (extracellular vesicles – EV). Một trong các yếu tố sinh trưởng và cytokine trong hệ tiết chính là TGF-β, HGF, và IL-10 [9, 10]. Do đó, có thể thấy CM có chứa hệ chất tiết từ MSC là một công cụ đầy hứa hẹn để điều trị các bệnh tự miễn dịch như bệnh nhược cơ. Mặc dù hiện nay chưa có bất kì thử nghiệm lâm sàng nào sử dụng MSC-CM trong điều trị bệnh nhược cơ, những dữ liệu và kết quả tích cực thu được từ nghiên cứu in vitro và in vivo cho thấy rằng việc nghiên cứu sâu hơn để đánh giá và sử dụng chúng là điều rất cần thiết.
Ái Vân
Tài liệu tham khảo
[1] D. B. Drachman, “Myasthenia Gravis,” New England Journal of Medicine, vol. 298, no. 3, pp. 136–142, Jan. 1978, doi: 10.1056/NEJM197801192980305.
[2] J. P. Sieb, “Myasthenia gravis: An update for the clinician,” Clin Exp Immunol, vol. 175, no. 3, pp. 408–418, Mar. 2014, doi: 10.1111/cei.12217.
[3] M. Sudres et al., “Preconditioned mesenchymal stem cells treat myasthenia gravis in a humanized preclinical model,” JCI Insight, vol. 2, no. 7, Apr. 2017, doi: 10.1172/jci.insight.89665.
[4] V. Sueblinvong et al., “Derivation of lung epithelium from human cord blood-derived mesenchymal stem cells,” Am J Respir Crit Care Med, vol. 177, no. 7, pp. 701–711, Apr. 2008, doi: 10.1164/rccm.200706-859OC.
[5] S. Gronthos, M. Mankani, J. Brahim, P. G. Robey, and S. Shi, “Postnatal human dental pulp stem cells (DPSCs) in vitro and in vivo.” [Online]. Available: www.pnas.orgcgidoi10.1073pnas.240309797
[6] A. Leyendecker, C. C. G. Pinheiro, M. T. Amano, and D. F. Bueno, “The use of human mesenchymal stem cells as therapeutic agents for the in vivo treatment of immune-related diseases: A systematic review,” Front Immunol, vol. 9, no. SEP, Sep. 2018, doi: 10.3389/fimmu.2018.02056.
[7] J. Yu et al., “Intravenous administration of bone marrow mesenchymal stem cells benefits experimental autoimmune myasthenia gravis mice through an immunomodulatory action,” Scand J Immunol, vol. 72, no. 3, pp. 242–249, 2010, doi: 10.1111/j.1365-3083.2010.02445.x.
[8] M. K. Majumdar, M. A. Thiede, J. D. Mosca, M. Moorman, and S. L. Gerson, “Phenotypic and functional comparison of cultures of marrow-derived mesenchymal stem cells (MSCs) and stromal cells,” J Cell Physiol, vol. 176, no. 1, pp. 57–66, Jul. 1998, doi: 10.1002/(SICI)1097-4652(199807)176:1<57::AID-JCP7>3.0.CO;2-7.
[9] M. Z. Ratajczak et al., “Pivotal role of paracrine effects in stem cell therapies in regenerative medicine: can we translate stem cell-secreted paracrine factors and microvesicles into better therapeutic strategies?,” Leukemia, vol. 26, no. 6, pp. 1166–1173, Jun. 2012, doi: 10.1038/leu.2011.389.
[10] H. Deng et al., “Lipid, Protein, and MicroRNA Composition Within Mesenchymal Stem Cell-Derived Exosomes,” Cell Reprogram, vol. 20, no. 3, pp. 178–186, Jun. 2018, doi: 10.1089/cell.2017.0047.






















